Luminiscenční analýza
Luminiscence je, jak známo, studené světélkování pevných látek a roztoků, řidčeji i plynů a par vzniklé transformací jiné primární energie, většinou světelného záření o nižší vlnové délce (fotoluminiscence), ale také chemickými reakcemi (chemoluminiscence), tepelnou stimulací (méně přesné je označení termoluminiscence), mechanickým tlakem (triboluminiscence), elektrickým polem (elektroluminiscence) a některými dalšími způsoby. Pro analytické účely mají význam však jen první tři druhy luminiscence. Je také třeba připomenout, že analýzu dělíme na kvalitativní a kvantitativní. Při kvalitativní analýze nám jde jen o důkaz nějaké látky, iontu či prvku vhodnou reakcí (zde luminiscenční), při kvantitativní analýze určujeme množství této látky nebo prvku, v našem případě obvykle měřením intenzity luminiscence vhodným přístrojem (fluorimetrem) s vizuálním hodnocením nebo dnes nejčastěji s hodnocením fotoelektrickým. Po stránce fyzikální lze pak připomenout, že luminiscence je záření představující nadbytek záření nad úrovní normálního teplotního záření daného Planckovým vyzařovacím zákonem. Na rozdíl od tepelného záření, které je výsledkem kmitání molekul a atomových skupin, záření luminiscenční má subatomární původ v elektronových přechodech, o čemž se zájemce dozví více ve speciální literatuře (Pátek, Neumanová, Luminiscence, SNTL 1962, Dvořák, Kupka, Fyzikální podstata luminiscence, SPN 1980).
Zdroj primárního záření
Nejvhodnějším zdrojem pro vybuzení fotoluminiscence je rtuťová výbojka. Ta emituje ve viditelné oblasti spektra žluté čáry 0,577 a 0,579 mikro m, zelenou čáru 0,546 mikro m, modrou 0,435 mikro m a dvě fialové cáry 0,408 a 0,405 mikro m. Pro praktické využití mají význam jen čáry fialové, někdy i čára modrá, ale největší význam má ultrafialová čára při 0,366 mikro m a výjimečně i jinak nejsilnější čára při 0,254 mikro m (uplatňuje se např. v zářivkách). Protože viditelné světlo ruší pozorování poměrně slabého luminiscenčního záření, zadržuje se vhodným filtrem, který ovšem propouští naopak nejvýznamnější čáru 0,366 mikro m. Takovým tmavým filtrem je např. jenské sklo UG l nebo podobné sklo Woodovo; v podstatě je to tmavě fialové sklo s přibližným složením 50 % Si02, 25 % BaO, 15 % K2O, 9 % NiO a 1 % CuO. Náhražkou takového filtru může být i tmavé kobaltové sklo, 1% roztok manganistanu draselného nebo 0,1% roztok krystalové violeti. Protože však tato media propouštějí i částečně červenou oblast spektra, je vhodné je kombinovat se světle modrým (fotografickým) filtrem B 1. Také lze použít jako filtru roztoku, který obsahuje asi 10 % síranu kobaltnatého a 5 % síranu měďnatého.
 |
Jako náhražky rtuťové výbojky lze použít i silnější elektrickou žárovku (od 60 W výše), kterou případně napájíme napětím o 5-10 % vyšším (z transformátoru). Je ovšem možné použít i 35W autožárovky 6 nebo 12 V. Taková žárovka ovšem produkuje mnoho tepla a červeného záření. Musí být tedy světlotěsně uzavřena, ale s dostatečným počtem větracích otvorů. Viditelné záření odfiltrujeme některým z výše uvedených filtrů, přičemž kombinace se světle modrým filtrem je zde nezbytná. Kdysi se vyráběly žárovky, které měly přímo baňku z tmavého nikelnatého skla a záměrně byly elektricky přetížené. Podobné baňky se někdy montují i dnes na rtuťové výbojky.
|
Pro vybuzení fotoluminiscence mnohdy stačí i světlo modrofialové. Ze světla rtuťové výbojky se pak izolují příslušné spektrální čáry opět vhodnými filtry nebo se použije kobaltnatého skla. Pamatujme si, že čím má luminiscenční záření větší délku vlny (žlutá až červená), tím větší délkou vlny je lze vybudit a vystačíme i s modrofialovým světlem, které příliš neruší, nebo je lze pro měření či pozorování odstínit žlutým filtrem. Pro luminiscenci fialovou až zelenou je však vhodná jedině blízká ultrafialová oblast.
Předběžné pokusy
Poslouží nám k demonstraci základních jevů a k ověření, že náš zdroj ultrafialového či alespoň fialového záření (zejména improvizovaný) je použitelný. Pokusy provádíme pochopitelně ve tmě, která nemusí být však dokonalá. Ovšem v naprosté tmě a asi po pětiminutovém přizpůsobení oka můžeme rozeznat i velmi slabou luminiscenci. Zkoušet můžeme mnoho běžných materiálů, jako jsou nálepky na krabičkách zápalek, bankovky, fluorescenční nátěry, reklamy, rostlinné i minerální oleje, tuky, skla a bižuterii, plastické hmoty, papíry a látky, organické látky, např. salicylan sodný, uranylové soli, ciferníky budíků a hodinek potřených svítící barvou apod. Slabě září i některé jiné anorganické soli a minerály.
Luminiscence minerálů a nerostných surovin
Luminiscence minerálů a nerostných surovin je značně závislá na jejich čistotě i znečištění (což je rozdíl). Byl to patrně první Homberg (1694), který poznal, že luminiscenci potlačuje železo, ale podporuje ji měď. Teprve za téměř 200 let ukázal Verneuil (r. 1886), že svítivost fialově zářící Balmainovy barvy je podmíněna obsahem nepatrného množství vizmutu. Kolem roku 1900 pak působnost různých kovových nečistot (aktivátorů) vyšetřili pro mnoho látek Klatt, Lenard, Tomaschek a další. Obecně lze udati tato pravidla:
1. Luminiscenci nejeví minerály kovového a polokovového vzhledu (kyzy, leštěnce), ani minerály tmavé (augit, turmalín), ani silně barevné a obsahující železo, nikl, kobalt, chrom a měď (i když tyto prvky někdy mohou být aktivátory).
2. Luminiscenci nejeví hmoty, které jsou sice světlé nebo bílé, ale velmi čisté. To mohou být některé vápence, křemeny, chlorid sodný aj.
3. Zelenou luminiscenci jeví však mnohé minerály uranu obsahující skupinu UO++ kromě minerálu torbrenitu (obsahuje mimo uran i měď) a karnotitu, který obsahuje vanad. Dále světélkují scheelity (CaW04) s obsahem molybdenu menším než 0,5 % modře, s vyšším obsahem bíle až žlutě. Willemit Zn2Si04 svítí zeleně, zirkon obvykle oranžově. Pro ostatní minerály není luminiscence nijak typická, protože se její charakter může značně měnit, nebo nemusí nastat vůbec. Jde např. o minerály jako sádrovec, strontianit, leukofan, safír, vápenec, fluorit aj. Fluoreskují-li vápence oranžově, obsahují mangan, ty, které svítí zeleně až modře, obsahují stopy mědi. Teplem stimulovanou luminiscenci (termoluminiscenci) jeví nejlépe kazivec (fluorit CaF2), což umožňuje jeho rozeznání v hornině. Stačí směs minerálů zahřát ve tmě na desce elektrického vařiče. Fluority (nikoliv všechny) se rozzáří fialové nebo zelenavě. Záření je patrně podmíněno předchozí aktivací dlouhým působením radioaktivního záření a obsahem stop vzácných zemin.
Vidíme, že uplatnění luminiscence v mineralogii je značně omezené a problematické a lze ji využít především k důkazu minerálů uranu (opět nikoliv všech) a k důkazu scheelitu. Ve většině ostatních případů slouží luminiscence jen k doplnění charakteristiky minerálu z určité lokality nebo pro zcela speciální případy, např. k detekci některých diamantů, zirkonů aj.
Použití luminiscence pro hodnocení zboží a materiálů
Do této skupiny lze zahrnout mnoho látek, materiálů včetně potravin; jejich popis by však zabral celou knihu. I kdyby to bylo možné, nebylo by to účelné, protože luminiscence zde závisí na mnoha faktorech. Lze udat např. její typické znaky jen pro určitou skupinu látek nebo určitý původ a podat jen obecné informace. Proto uvádím jen několik typických příkladů:
1. Látky, papíry, barviva: mnohé bílé látky a papíry se opticky vyjasňují přídavkem fialově fluoreskujících látek, které na denním světle kompenzují původní žlutavý odstín. Takto impregnované látky září v ultrafialovém světle obvykle modrobíle. Barevně září i látky vybarvené fluorescenčními barvivy.
2. Minerální a rostlinné oleje a tuky: Minerální oleje a tuky (tj. získané z ropy či dehtu) jeví silnou modrou až zelenou luminiscenci, naproti tomu rostlinné oleje a tuky září jen velmi slabě. Tak lze obě skupiny tuků spolehlivě rozeznat i poznat, zda neznečišťují jiné kapaliny (alkohol, aceton, voda, benzin, benzen) či hmoty. Impregnujeme-li však minerálním olejem některé porézní hmoty, můžeme dobře v ultrafialovém světle zkoumat jejich povrchovou strukturu.
3. Odlišování padělků: některé bankovky, šeky, známky bývají označeny číslem nebo nějakým drobným detailem luminiscenčních vlastností, který slouží k identifikaci jejich pravosti. Podobně tomu může být i u pravých a uměle vyrobených polodrahokamů.
4. Potravinářství: čerstvé mléko a máslo má fluorescenci žlutou, později je modravá. U čerstvého vejce bílek nefluoreskuje, začne však modravě zářit stárnutím. Lůj i vepřové sádlo nezáří, umělé tuky září modravě, rostlinné tuky fialově šedě.
5. Organické sloučeniny a barviva: platí zde jedno zásadní, ale jednoduché pravidlo - fluoreskují pouze některé aromatické sloučeniny, tj. sloučeniny obsahující benzenové nebo naftalénové jádro, ovšem ve viditelné oblasti jen za přítomnosti některých atomových skupin. Nefluoreskují-li, jde o sloučeniny alifatické nebo některé jednodušší sloučeniny aromatické. Porovnejme např. fluorescenci antracenu, salicylanu sodného s cukrem nebo kyselinou vinnou.
6. Kontrola luminoforů: V dnešní době, kdy se spotřebuje velké množství luminoforů pro zářivky a televizní obrazovky, se tyto materiály pochopitelně hodnotí hned po přípravě.
Důkaz a stanovení anorganických a organických látek
Jak jsme viděli v předchozích odstavcích, ke luminiscencí dokazovat látky většinou jen ve speciálních případech a jen za jistých okolností.
Tak např. charakter atomů (iontů) železa, niklu, kobaltu, chrómu taková stanovení vylučuje. Naopak fluorescenční stanovení berylia morinem je jednou z nejcitlivějších metod, umožňujících stanovení až 1 mikro g Be v 50 ml roztoku. V analytické chemii v luminiscenční analýze uplatňujeme dvě zásady:
1. Stanovovaný prvek (iont) či látku nejprve izolujeme a koncentrujeme, zpravidla extrakcí organickým rozpustidlem, někdy i jinak, např. destilací. Tak např. petroléterem, benzinem apod. extrahujeme tuky, chlorofyl, karoteny aj. Extrakt lze často použít přímo k vyvolání fluorescence. U anorganických iontů můžeme např. oddělit stopy galia z prostředí N HC1 extrakcí iontu GaCl4- do éteru, odpařením extraktu a stanovením galia v odparku podle dalšího bodu.
2. Pokud izolovaná sloučenina sama nefluoreskuje, převádíme ji na sloučeninu fluoreskující, která je vhodná pro důkaz či stanovení. Tak pro anorganické ionty jsou vhodná tato činidla:
činidlo - ionty, s nímž dává fluoreskující sloučeninu
morin: Be, AI, Ga, In, Zn, Th, Zr, Sb, Sn fluorescence v roztoku je zelená, optimální pH je pro AI, Ga a In 3, pro Zn pH 7, pro Sb, Sn, Zr, Th pH 0,5 až 3, pro Be pH 10.
8 hydroxychinolin: Al, Ga, In, Zr, Th, Zn, žlutozeleně fluoreskující sraženiny, rozpustné v chloroformu, opt. pH 2 až 4, pro Mg pH 9, jako činidla lze použít i příslušné sulfokyseliny, vzniklý komplex je pak rozpustný ve vodě.
Využití chemiluminiscence
Chemiluminiscence se zásadně liší od fotoluminiscence tím, že záření zde vzniká jako částečný produkt chemické, zpravidla oxidační reakce. Proto také zde nepotřebujeme žádný primární budicí zdroj, ale jen vhodné reakční podmínky. V přírodě je chemiluminiscence hojně rozšířena jako světélkování hmyzu, bakterií, hub, hlubinných ryb, tlejícího dřeva apod. a označujeme ji zde jako bioluminiscenci. Světélkování bílého fosforu je pak typickou anorganickou chemiluminiscencí. Že skoro každá chemická reakce je provázena slabým zářením, prokázal již v polovině třicátých let u nás O. Viktorin. Avšak teprve když roku 1928 objevil Albrecht velmi silné chemiluminiscenční vlastnosti hydrazidu kyseliny aminoftalové - luminolu - mohlo být tohoto jevu využito v praxi, a to především k důkazu stop peroxidu vodíku a krve. V alkalickém prostředí, při pH kolem 11, jeví luminol za přítomnosti silných oxidačních činidel jako ozonu, chlornanu, kyanoželezitanu nebo manganistanu intenzívní, i když krátkodobou modrou luminiscenci roztoku. Peroxid vodíku dá však až hodinu trvající luminiscenci, ale jen za přítomnosti vhodného katalyzátoru. Nejlepším katalyzátorem je hemoglobin nebo jeho derivát hemin a samozřejmě i krev. Protože působí i starší, zaschlé stopy krve, bylo luminolu využito k jejímu důkazu např. v kriminalistice. Protože příprava hemoglobinu z krve je poměrně obtížná a použití samotné krve činí potíže (uchovávání krve), nalezl autor t. čl. plnou náhradu hemoglobinu v triethanolaminovém komplexu trojmocného kobaltu (Talanta 1976, str. 553). Tento katalyzátor se připraví rozpuštěním 0,5 g dusičnanu kobaltnatého a 2,5 ml triethnalaminu asi v 50 ml vody. Ponechá se stát za občasného protřepání na vzduchu asi dvě hodiny, pak se doplní vodou do 100 ml. Důkaz peroxidu ve vodě (např. v dešťové vodě, v chladící vodě atomového reaktoru) se provede tak, že ke 100 ml vody se přidá 5 ml 0,05 % luminolu v 7 % NaOH a 0,2 ml roztok Co katalyzátoru. Pro třepe se a pozoruje se ve tmě. Roztok luminolu musí být starý nejméně týden, čerstvý reaguje slabě. Další podrobnosti nalezne zájemce v článcích dr. Kubala (Chem. listy 1968 str. 1478, 1970 str. 113). Vizuálně lze zjistit ještě asi 10 -5 % peroxidu, fotonásobičem až 10 -8%.
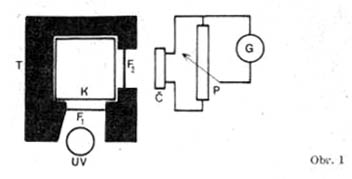
Konstrukce fluorimetru pro školní potřeby
Podle obr.1 lze poměrně snadno zhotovit fluorimetr z dostupných součástí. Základní těleso T je zhotoveno z tvrdého dřeva černě nabarveného a napuštěného parafinem či lakem. Lze ovšem použít i kovu. Vnitřní prostor je tvarován podle použité kyvety K, kterou může být širší nízká zkumavka nebo užší kádinka, skleněná čtverhranná kyveta, případně slepená z umaplexu. UV je zdroj ultrafialového záření, Fx příslušný filtr izolující záření v mezích (0,366 až 0,405) mikro m, F2 je skleněný filtr pohlcující zbytky ultrafialového a fialového záření - zcela vyhoví fotografický žlutý nebo zelený filtr pro zelenou luminiscenci. Pro modrou luminiscenci použijeme jen slabý filtr žlutý, popř. ultrafialový. Č je světelné čidlo, v našem případě patrně nejlépe selenový fotočlánek připojený přes potenciometr P k citlivému zrcátkovému galvanometru. Použití fotoodporu nebo fotonásobiče vyžaduje elektronický zesilovač, jehož popis se vymyká poslání tohoto článku.
Práci s fluorimetrem můžeme demonstrovat pomocí 0,05 % roztoku fluoresceinu (Lachema) ve zředěném amoniaku. Roztok nalijeme do kyvety a citlivost nastavíme potenciometrem na maximální výchylku galvanometru. Roztok potom několikráte vždy zředíme stejným objemem zředěného amoniaku (asi 2%) a opět změříme výchylky galvanometru. Uvidíme, že při vysokých koncentracích fluoresceinu výchylka (a tedy i intenzita fluorescence) zůstává stejná a začne klesat až od určité koncentrace. Grafické vynesení závislosti výchylky galvanometru a koncentrace fluoresceinu dá potom křivku, kterou lze použít ke zjišťování neznámé koncentrace fluoresceinu. Jak se postupuje v jiných případech, dočte se zájemce v knize Z. Hohbechera Luminiscenční analýza, kterou lze vypůjčit v odborné knihovně.
Některé další aplikace luminiscence
I když dnes máme metody pro stanovení stopových prvků lepší, je vhodné se nakonec zmínit o důkazu některých prvků na základě jejich aktivační schopnosti v základním materiálu. Důkaz je značně citlivý, omezuje se však na čisté roztoky, jejich odparky a koncentráty. Je však snadno proveditelný. Patrně nejjednodušší je důkaz antimonu. Nepatrné množství antimonité soli rozetřeme v misce asi s 10 g chloridu draselného. Směs bez jakéhokoliv žíhání září v ultrafialovém světle žlutě. Někdy je nutno směs zahřát v sušárně. Důkaz manganu, antimonu a vizmutu (až 10~8 g) ve vodě lze provést tak, že v ní rozmícháme trochu uhličitanu vápenatého, suspensi vneseme do platinového očka a silně vyžíháme v plamem. Když po vychladnutí hmotu přiblížíme k dolní části plamene, potom vlivem pomalých elektronů se objeví v přítomnosti manganu luminiscence žlutá, v přítomnosti antimonu světle modrá. Vizmut dá barvu chrpově modrou, měď bělomodrou. Měď v destilované (i jiné) vodě lze dokázat provlhčením uhličitanu barnatého, vysušením, smísením asi s 0,2 dílu síry a vyžíháním v uzavřeném porcelánovém kelímku v elektrické pícce asi při 700°C po dobu 15 minut. Současně provádíme kontrolní pokus (bez provlhčení vodou) a po vychladnutí oba vzorky porovnáme pod UV světlem. Měď dá žlutou až oranžovou luminiscenci. Tak můžeme dokazovat měď i jiné kovy např. v popelu rostlin nebo v živočišném materiálu. Můžeme také použít čisté mořské lastury, skořápky našich škeblí nebo skořápky vajec. Ty napřed rozdrtíme, vyžíháme a znovu rozetřeme nyní za přídavku 1/3 dílu síry. Vyžíháme podobně jako nahoře a pozorujeme v UV světle. Mangan dá záření žluté, měď modrozelené, vizmut fialové, olovo žlutozelené. Výsledek ovšem může být i nulový. Uran je zase nejlépe dokazovat v perličce taveniny fluoridu sodného. Září žlutě.
Ing.
Věnceslav Patrovský, CSc.
Rozhledy mat.
fyz. 61, 1982/3, 341-347
